Alkohol
Az alkohol (etanol) tápanyagnak tekinthető (7 kcal/g), vízben és zsírban is korlátlanul oldódó enyhén mérgező vegyület. Már a szájnyálkahártyán keresztül elkezd felszívódni, de főképp a portális keringéssel jut a májba, amely a fő metabolizálója.
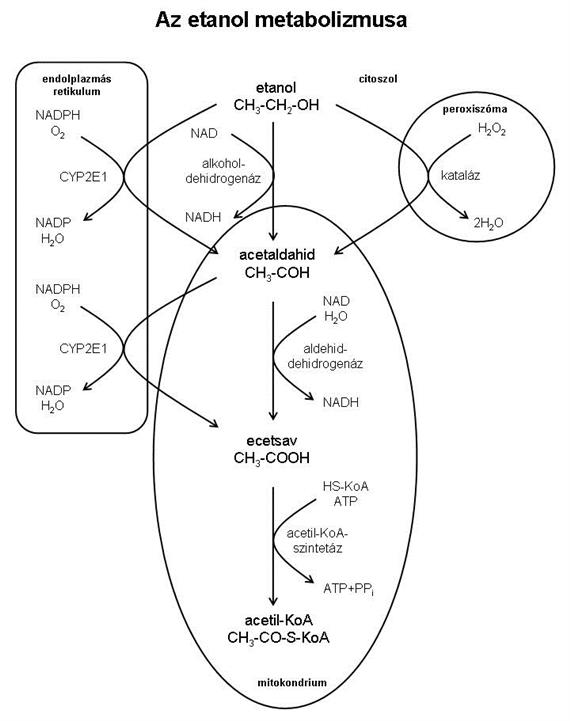
Az alkohol lebontása a májban többféle úton haladhat, de alapvetően három lépésben, acetaldehiden és ecetsavon keresztül végül acetil-KoA keletkezik belőle, amely bekerülhet a citrátkörbe, vagy lipidek (zsírsavak, koleszterin), ill. az oxálacetát hiánya esetén ketontestek szintetizálódnak belőle.
Az alkohol a májban viszonylag gyorsan metabolizálódik, egy egészséges, nem alkoholista felnőtt mája átlagosan óránként kb. 10 g alkoholt képes lebontani. Az alkoholfogyasztás hatásai lehetnek rövid és hosszú távúak is.
Azonnali, akut következmények:
- Az alkohol részleges szétkapcsoló szer. A mitokondriális elektrontranszport-lánc alkohol jelenlétében ugyan gyorsabban működik, mint normális esetben, és az oxigénfogyasztás is nő, mégis csökken az ATP-termelés.
- Az alkohol akut magnézium diuretikum, azaz gyorsan a magnézium (és más elektrolitok) vizelettel történő kiválasztásának erőteljes növekedését okozza (Rivlin, 1994).
- Az ATP-szintetáz csak a mitokondrium membránjához kötött állapotban fejtheti ki a hatását, és a magnézium növeli a kötődést (ún. kapcsolt, coupling állapot), míg magnézium hiányában az elektrontranszport és az oxigénfelvétel ATP szintézise nélkül megy végbe (ún. szétkapcsolt, uncoupling állapot), és ATP képződése helyett csak hő termelődik.
- A magnézium jelenléte az ATP-képződésnek, míg a csökkent magnéziumkoncentráció a szétkapcsolt állapotnak kedvez (Ahsan, 1997).
- A fokozott oxigénfelhasználás okozhat lokálisan hipoxiás körülményeket, megzavarva ezzel a normális metabolizmust (oxidatív stressz).
- Az etanol hatással lehet különböző receptor-ioncsatornák működésére (GABA, NMDA). A megváltozott ion-egyensúly elsősorban az idegrendszer sejtjeinek patológiás működését okozhatja.
- Ezzel magyarázható az alkoholfogyasztás következtében megváltozott viselkedési mintázat (vidámság, gátlástalanság, erőszakosság), a lassú felfogóképesség és reakcióidő.
- Az alkohol átalakulásakor az alkohol-dehidrogenáz és az aldehid-dehidrogenáz enzimek jelentős mennyiségű NADH-t termelnek, és ez három tényezőn keresztül a májsejtekben a lipidek kóros felszaporodását, a zsírmáj (akut módon átmeneti) kialakulását okozhatja.
- A NADH-többlet egyrészt eltolja a piruvát-laktát átalakulási reakciót a laktát képződésének irányába, ezért tejsavas acidózis léphet fel, ami a vér pH-jának csökkenését, ezáltal rosszullétet, súlyosabb esetben ájulást, kómát okozhat.
- A sok keletkezett NADH ezen kívül gátolja a citrátkör és a zsírsav-oxidáció enzimeit, így a metabolizmust a zsírsav-szintézis irányába mozdítja, miközben gátolja a zsírsavak lebontását.
- A sok NADH a glicerin-3-foszfát keletkezésének irányába tolja el a glicerin-3-foszfát-dehidrogenáz (G3PDH) enzim által katalizált reakciót, ami a glicerin-3-foszfát felszaporodását, ill. azt okozza, hogy a NADH-ok a glicerofoszfát ingán keresztül jutnak az elektrontranszport-láncra, ami szintén csökkenti az ATP-produkciót. Bővebben itt.
Krónikus következmények:
- Az etanol képes a membrán foszfo-gliceridek zsírsav-észtereivel reakcióba lépni. A leszakadó zsírsav-etilészterek miatt az ott maradó membrán rigiditása (fluiditása) megváltozik, ami károsítja a membrán működését. Ez szintén kihat a sejtek (pl. idegsejtek) működésére.
- Rendszeres alkoholfogyasztás esetén a CYP2E1 indukálódik, mennyisége megnövekszik (nem az enzim átírását fokozza, hanem etanol jelenlétében megnő az enzim féléletideje). Mivel a CYP2E1 a biotranszformáció előkészítő fázisában szereplő monooxigenáz, fokozott működésének következtében felszaporodhatnak az endo- vagy xenobiotikumokból képződött mérgező intermedierek.
- Az etanol metabolizmusa során keletkező intermedier, az acetaldehid erős méreg, kovalens kötéssel kapcsolódva ún. adduktokat képez más molekulákkal (acetaldehidaemia), súlyosan károsítva azok működését.
- Pl. a máj apolipoproteinjeit károsítva akadályozza a VLDL termelést, a tubulin citoszkeletális fehérjéket károsítva pedig akadályozza a már elkészült VLDL szekrécióját. Ezek a defektek elősegítik a zsírmáj kialakulását.
- Ha az adduktok képződése a DNS-hibajavító enzimeket vagy a glutationt (GSH) károsítja, akkor a csökkent antioxidáns védelem a csökkent hibajavító képességgel a DNS-mutációk elszaporodását okozhatja, ami elősegítheti májrák kialakulását.